Lesson Progress
0% Complete
ජීවය සඳහා වැදගත් වන ජලයේ භෞතික හා රසායනික ගුණ
- ජලය, ජීවය සමඟ අතිශයින්ම බැඳුණු අජීවී පදාර්ථයකි. ජීවය සම්භවය වූයේ ජලයයේය. ජීවය පවතින්නේද ජලය නිසාය. ජලය නොමැති නම් ජීවයක් ද නොපවතී.
- ජලයේ ජෛව විද්යාත්මක වැදගත්කම සඳහා මූලිකවම හේතු වනුයේ එය,
- සියලු ජීවීන්ට ජෛව විද්යාත්මක මාධ්යයක් සැපයීම හා
- ජීවී සෛලවල වැදගත් රසායනික සංඝටකයක් වීම නිසායි.
ජලය ජීවීන්ට ඉතා හොඳ ජෛව විද්යාත්මක මාධ්යයක් සපයන අවස්ථා වලට උදාහරණ
- ජීවී දේහය පුරා ද්රව්ය පරිවහනය වීම සඳහා අවශ්ය මාධ්යය වේ (නිදසුන් – රුධිරය, ප්ලෝයම යුෂ).
- සෛල තුළ ජෛව රසායනික ප්රතික්රියා සිදු වන මාධ්යය වේ (නිදසුන් – එන්සයිම ප්රතික්රියා).
- ප්රජනනයේ දී ජන්මාණු හා බීජාණුවල ව්යාප්තියට උපකාර වන මාධ්යයක් වේ.
- පරාග, ඵල හා බීජ ව්යාප්තියට උපකාර වන මාධ්යයක් වේ.
- ජලජ ජීවීන්ට ජීවත් වීමට මාධ්යයක් සපයා දෙයි (නිදසුන් – වාසස්ථානයක් සැපයීම, සන්ධාරක මාධ්යයක් සැපයීම, ව්යාප්තිය සඳහා මාධ්යයක් සැපයීම).
ජලය ජීවී සෛලවල වැදගත් රසායනික සංඝටකයක් ලෙස ක්රියා කරන අවස්ථා
- ජලය, සමහර ජෛව රසායනික ප්රතික්රියාවල ප්රතික්රියකයක් ලෙස ක්රියා කරයි (උදා: ප්රභාසංශ්ලේෂණය).
- විවිධ අණු ද්රාව්ය තත්වයෙන් තබා ගන්නා මනා ද්රාවකයක් ලෙස ක්රියා කරයි.
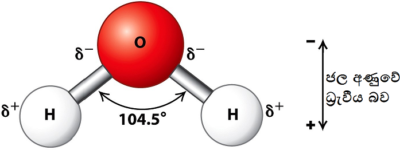
δ+ භාගිකව ධන ආරෝපිත δ– භාගිකව ඍණ ආරෝපිත
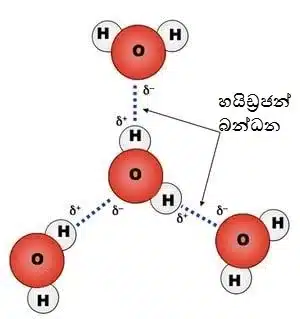
ජලයේ හයිඩ්රජන් බන්ධන ( රූපය අදින්න)
|
පෘථිවිය මත ජීවය පවත්වාගෙන යෑමට අවශ්ය ජලයේ ප්රධාන ගුණ හතර
- ජල අණු වල සංසක්ති හැසිරීම.
- උෂ්ණත්වය මධ්යස්ථ කිරීමට ඇති හැකියාව.
- හිමායනයේ දී සිදු වන ප්රසාරණය.
- ද්රාවකයක් ලෙස ඇති සර්වනිපුණත්වය.
කෘත්යවලට අදාළ ජලයේ ගුණ
- සංසක්ති හැසිරීම
- හයිඩ්රජන් බන්ධන නිසා ජල අණු අතර, ඇති ආකර්ෂණය සංසක්තිය ලෙස හඳුන්වයි. ජල අණු සහ වෙනත් ද්රව්ය අතර, ඇති වන ආකර්ෂණය ආසක්තිය ලෙස හඳුන්වයි. ඉහත ගුණ දෙක නිසා පරිවහන මාධ්යයක් ලෙස ක්රියා කිරීමේ හැකියාව ජලයට ලැබී ඇත.
- ජල අණු අතර, ඇති සංසක්තිය නිසා ජලය සහ ජලයේ ද්රාව්ය ඛනිජ ලවණ සහ පෝෂක ද්රව්ය වැනි දිය වූ ද්රව්ය සනාල පටක වන ශෛලමය සහ ප්ලෝයම තුළින් ගුරුත්වයට එරෙහිව පරිවහනය වේ.
- ජලය සහ ජලයේ දිය වූ ද්රව්ය පරිවහනයේ දී ජල අණු සහ සෛල බිත්ති අතර ඇති ආසක්තිය ද ආධාර වේ.
- ජලයට ඉහළ පෘෂ්ඨික ආතතියක් ඇත. ජල අණු අතර, ඇති සංසක්තිය නිසා ජල අණුවලට එම හැකියාව ලැබී ඇත. එනිසා ජලජ පද්ධතියක් තුළ ඉහළ පෘෂ්ඨයේ ජල අණු පහළ පෘෂ්ඨයේ ජල අණු මඟින් ආකර්ෂණය කර ජල පටලයක් සාදයි. එනිසා කුඩා කෘමීන්ට පොකුණක ජල පෘෂ්ඨය මත ඇවිදීමට හැකි ය. උදා : දිය ලිස්සන්නා

2. උෂ්ණත්වය මධ්යස්ථ කිරීමට ඇති හැකියාව
- ජලයේ උෂ්ණත්වයේ සුළු වෙනස්වීමක් මගින් සාපේක්ෂව අධික තාප ශක්ති ප්රමාණයක් ජලයට අවශෝෂණය කිරීම හෝ නිදහස් කිරීම කළ හැකි ය. අධික විශිෂ්ට තාපය නිසා පෘථිවිය මත උෂ්ණත්ව උච්චාවචනය සිදු වන විට ජීවි පද්ධති සහ ජල ස්කන්ධ තුළ ජලය තාප ස්වාරක්ෂකයක් ලෙස ක්රියා කරයි.
- අධික වාෂ්පීකරණ තාපයක් ඇති නිසා ජීවියකු තුළ අවම ජල හානියක් සිදු කරමින් වැඩි තාප ශක්තියක් නිදහස් කළ හැකි ය. එනිසා ජීවියකුගේ දේහ පෘෂ්ඨය සිසිල් පෘෂ්ඨයක් ලෙස පවත්වා ගනී.
උදා: අධික උණුසුම් වීම වැළැක්වීමට
- මිනිස් සමෙන් ස්වේදය වාෂ්ප වීම, දේහ උෂ්ණත්වය නියත මට්ටමක පවත්වා ගැනීමට ආධාර වේ. ශාකවල සිදු වන උත්ස්වේදනය මගින් ශාක දේහ පෘෂ්ඨය සිසිල් පෘෂ්ඨයක් ලෙස තබා ගන්නා අතර, සූර්යාලෝකය නිසා අධිකව උණුසුම් වීම වළක්වයි.
3. හිමායනයේ දී සිදු වන ප්රසාරණය
- සාමාන්යයෙන් ද්රව්යයක උෂ්ණත්වය වැඩි වන විට ඝනත්වය අඩු වන අතර, උෂ්ණත්වය අඩු වීමේ දී ඝනත්වය වැඩි වේ.
- ජලයේ උෂ්ණත්වය 4 °Cට වඩා අඩුවන විට හිමායනය වීම ආරම්භ වී අයිස් ඝනක (කුට්ටි) ලෙස හඳුන්වන ස්ඵටික දැලිසක් සාදයි.
- එනිසා ජලයට 4 °C දී උපරිම ඝනත්වයක් ඇත. එබැවින් ජල ස්කන්ධවල මතුපිට පෘෂ්ඨයේ අයිස් පා වේ. මෙය ධ්රැව ප්රදේශවල ජල ස්කන්ධ තුළ සිටින ජීවීන්ට ශීත ඍතුවේ දී නොනැසී පැවතීමට හැකිවන ජලයේ වැදගත් ගුණාංගයකි.
4. ද්රාවකයක් ලෙස ඇති සර්වනිපුණත්වය
- ජලයේ ධ්රැවීයතාව නිසා ජලයට ලැබී ඇති ගුණයකි.
- එනිසා ධ්රැවීය අණු (උදා: ග්ලූකෝස්), නිධ්රැවීය අයනික සංයෝග (උදා: සෝඩියම් ක්ලෝරයිඩ්), ධ්රැවීය සහ අයනික (උදා: ලයිසොසයිම්) යන ඒවා ජලයේ දිය වේ. ජල අණු එක් එක් ද්රව්ය අණු වට කර, ඒවා සමඟ හයිඩ්රජන් බන්ධන සාදයි. ද්රාව්යතාව අයනික ස්වභාවය මත නොව, ධ්රැවීයතාව මත රඳා පවතී.